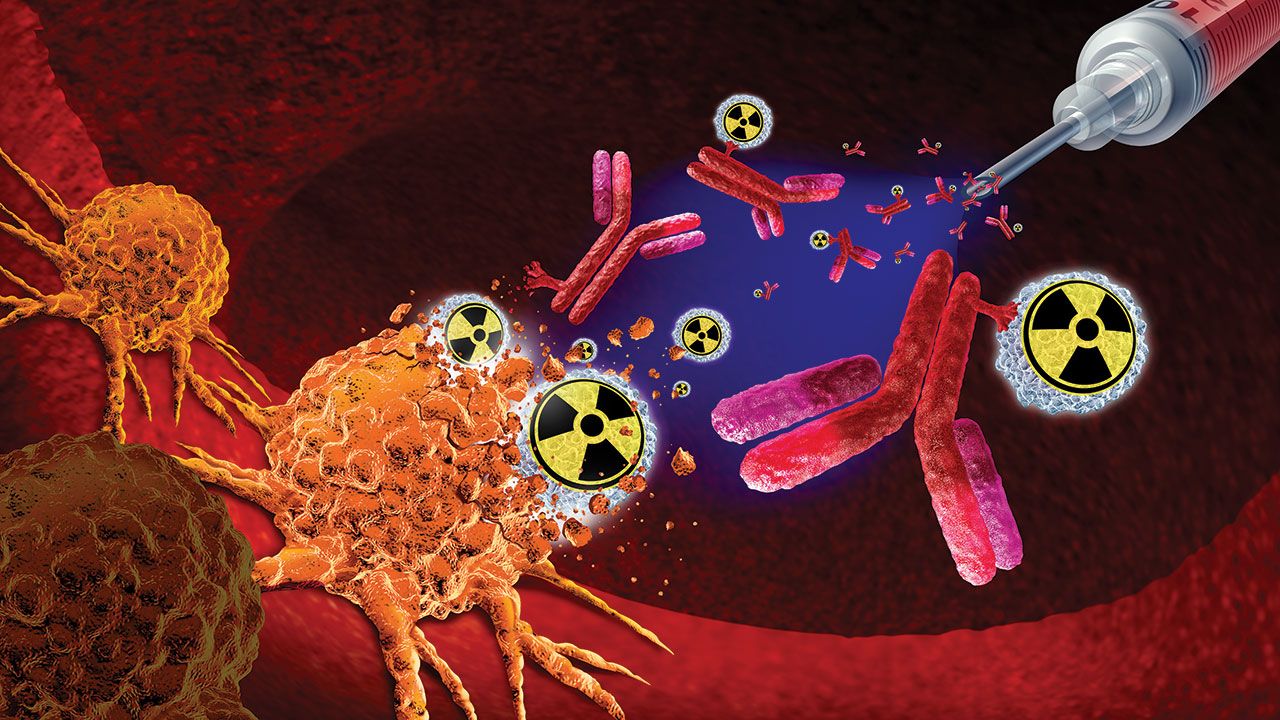
Mengapa Radiofarmasi Ideal untuk Mengobati Kanker
Radiofarmasi telah mengalami lonjakan penelitian dan uji klinis sebagai pengobatan kanker karena kemampuannya menargetkan sel kanker tertentu. Studi menunjukkan bahwa terapi radiasi yang ditargetkan dapat mengurangi risiko efek samping, menurut National Cancer Institute di National Institutes for Health (1).
“Radiofarmasi juga bekerja paling baik bila obat dapat masuk ke dalam sel. Namun hal tersebut belum tentu efektif. Begitu radiofarmasi menempel pada sel kanker, senyawa radioaktif akan terurai secara alami. Peluruhan ini melepaskan energi yang merusak DNA sel di dekatnya. Dan bila DNA sel mengalami kerusakan yang tidak dapat diperbaiki lagi, sel tersebut akan mati. Sel kanker sangat sensitif terhadap kerusakan DNA akibat radiasi” (1).
Teknologi Farmasi® berbicara dengan Michael Ritchie, chief komersial officer di Champions Oncology, untuk mencari tahu apa yang membuat radiofarmasi unik untuk pengobatan kanker.
Ritchie juga berbicara tentang rancangan dokumen panduan FDA, Radiofarmasi Terapi Onkologi: Optimasi Dosis Selama Perkembangan Klinisyang diterbitkan lembaga tersebut pada 18 Agustus 2025 (2). Panduan ini dibuat untuk membantu sponsor obat dalam mengidentifikasi dosis optimal terapi radiofarmasi untuk indikasi onkologi selama pengembangan klinis.
PharmTech: Apa yang unik dari penggunaan radiofarmasi untuk mengobati kanker?
Ritchie (Juara Onkologi): Sebenarnya, obat-obatan radio telah ada sekitar 100 tahun terakhir. Mereka digunakan sejak awal untuk mengobati tumor yang lebih dangkal (seperti) melanoma dan menggunakan mesin besar untuk mengarahkan radiasi terfokus ke tumor. Dan seiring berkembangnya teknologi, kami mampu mengobati lebih banyak tumor internal.
Jadi, hal ini sudah ada sejak lama, namun saat ini kita sedang berada di tengah-tengah transformasi dalam bidang radiofarmasi, dan sebagian besar transformasi tersebut disebabkan oleh bidang yang disebut konjugat antibodi-obat (ADC). (ADC) telah ada cukup lama. Itulah gagasan ajaib bahwa Anda dapat menggunakan obat kemoterapi atau sesuatu yang sangat beracun bagi setiap sel pasien dan mengarahkannya ke tumor, khususnya, sehingga Anda hanya berdampak pada tumor dan tidak pada yang lain. Obat pertama disetujui pada tahun 2000. Ini adalah obat yang disebut Mylotarg, dan kami membutuhkan waktu 25 tahun untuk memahami dengan baik apa yang membuat ADC bagus. Dimana cara-cara tersebut bisa efektif? Dari sudut pandang terapeutik, apa yang perlu kita lakukan agar obat ini bertahan lama pada pasien?
Sekarang kita telah (melihat) respons yang sangat kuat dan tahan lama pada pasien dengan ADC. Sekarang setelah kita memiliki pemahaman yang baik mengenai hal tersebut, kita dapat mengambil ligan radio ini, yang pada dasarnya adalah sebuah elemen pada tabel periodik yang memasukkan radiasi secara terfokus, dan kita dapat mengkonjugasikannya menjadi antibodi dengan cara yang sama seperti cara kerja ADC ini. Maka, dengan semakin suksesnya ADC, kini kita memiliki konjugat obat radio, dan kita mulai melihat orang-orang menggunakan ligan radio dengan cara yang mirip dengan kemoterapi dan mengarahkannya ke pasien yang diberikan secara sistemik. Ini benar-benar periode yang menggembirakan, karena ini merupakan mekanisme tindakan baru yang berpotensi mengatasi kebutuhan yang belum terpenuhi.
PharmTech: Apa saja tantangan spesifik yang terkait dengan pengembangan radiofarmasi?
Ritchie (Juara Onkologi): Ada tantangan nyata di seluruh bidang. Ada tantangan pengembangan terapeutik serta biologi dalam pengobatan tumor ini. Dari perspektif pengembangan terapi, kita masih dalam tahap awal dalam hal pemahaman kita mengenai obat yang baik.
Ada begitu banyak hal yang (dimasukkan) ke dalam pengembangan farmasi (untuk membuat) sesuatu yang dapat diproduksi dalam skala besar. Itu bisa diletakkan di rak untuk sementara waktu. Kita dapat memberikannya kepada pasien, dan perilakunya sesuai dengan keinginan kita. Semua ilmu kimia itu, semua perkembangan biologi itu, kita baru belajar bagaimana menerapkan apa yang kita pelajari dari ADC ke dalam konjugat obat radio, jadi ilmu kimia tentang bagaimana menghubungkan ligan radio ini dengan antibodi, adalah sesuatu yang akan terus berkembang, dan ada peluang nyata di sana untuk meningkatkan aktivitas terapeutik.
Dari perspektif biologi, sekali lagi, kita masih dalam tahap awal dan memahami jenis tumor atau kelompok molekuler apa saja dalam tumor yang lebih sensitif terhadap ligan radio. Seperti halnya kemoterapi atau terapi apa pun, tumor tertentu akan merespons. Yang lain tidak akan melakukannya. Mereka akan mengembangkan perlawanan. Jadi benar-benar memahami kelompok pasien yang tepat untuk diobati adalah sesuatu yang masih kami pelajari, dan saya pikir kami akan terus belajar seiring dengan berkembangnya perkembangan klinis dari program-program ini.
PharmTech: Bisakah Anda menjelaskan bagaimana model xenograft (PDX) yang diturunkan dari pasien dengan anotasi klinis digunakan dalam pengujian radiofarmasi?
Ritchie (Juara Onkologi): PDX digunakan dari beberapa perspektif berbeda dalam pengujian radiofarmasi. Hal ini kembali ke rintangan kedua yang perlu kita atasi dalam memahami respons jenis tumor atau kelompok molekuler. Sangat penting bagi Anda untuk melakukan pengujian obat dan membuat model yang mewakili tumor yang akan dihadapi oleh obat Anda di klinik. Pasien cenderung mendapat pengobatan awal yang berat. Ketika mereka meminum obat eksperimental, tumor mereka telah bermetastasis ke banyak organ, dan sayangnya, lesi itulah yang pada akhirnya membunuh tumor tersebut. Lesi itulah yang memerlukan obat untuk melawannya secara efektif. Jadi, menggunakan model yang mewakili biologi tersebut adalah kuncinya. Kami mensimulasikan uji klinis pada hewan di mana kami akan mengambil bank tumor kami, kami akan menumbuhkannya pada hewan, dan kemudian Anda akan menguji obat Anda di perpustakaan luas tumor (yang) mensimulasikan uji klinis tersebut. Kemudian, ketika Anda melihat di mana Anda memiliki efek dan di mana Anda tidak memiliki efek, kami akan melihat secara mendalam sifat molekuler tumor ini dan mencoba memprediksi di klinik pasien mana yang harus menerima obat tersebut karena merekalah yang paling mungkin mendapat manfaat dibandingkan pasien yang mungkin mendapat manfaat dari jenis terapi lain.
PharmTech: Mengapa penting menggunakan data dunia nyata dalam jenis pengujian ini?
Ritchie (Juara Onkologi): Data dunia nyata adalah kumpulan data yang sangat penting, dan sudah ada sejak lama. Dan pendapat saya tentang data dunia nyata adalah, apakah ada informasi tentang pasien? Apa stadium tumornya, sifat metastasisnya? Dengan apa mereka diperlakukan? Bagaimana tanggapan mereka?
Itu adalah lapisan yang sangat penting. Tapi menurut saya ada sisi lain yang perlu kita pikirkan, yaitu, apa sifat molekuler tumor yang terkait dengan pasien tersebut? Apa yang membuat tumor tersebut berkembang? Apa saja kerentanan dan dampak buruk dari tumor tersebut yang berpotensi Anda manfaatkan dalam pengembangan terapi? Menurut saya Champions sebenarnya adalah salah satu perusahaan unik yang memiliki kedua sisi mata uang tersebut. Kami memiliki kumpulan data besar yang berisi bukti dunia nyata yang terkait dengan data molekuler yang sangat mendalam dari tumor, pengurutan seluruh sel exome, RNA (pengurutan), proteomik, fosfolipid, proteomik permukaan sel. Hal ini benar-benar memungkinkan para peneliti untuk mendalami (dan) memahami karakteristik molekuler tumor yang berpotensi berdampak pada kelangsungan hidup (dan) berdampak pada resistensi terhadap terapi. Ini hanya memberi mereka wawasan nyata sejak awal (tentang) bagaimana merancang uji klinis mereka. Saat perusahaan datang ke Champion dan melakukan simulasi uji klinis, mereka menggunakan data ini untuk tujuan prediksi dan mendorong wawasan yang lebih luas.
PharmTech: Bagaimana rancangan pedoman baru FDA mengenai identifikasi dosis untuk uji klinis radiofarmasi onkologi berdampak pada pengembangan dan persetujuan pengobatan ini?
Ritchie (Juara Onkologi): Radiofarmasi klasik mengandalkan sesuatu yang disebut EBRT, atau radioterapi pancaran eksternal, dan pada dasarnya mengirimkan pancaran radio ke pasien dari sumber eksternal. Namun saat ini kita sedang melihat gelombang terapi baru yang disuntikkan secara sistemik, dan sejujurnya, kita belum cukup mengetahui tentang terapi tersebut. Oleh karena itu, FDA telah merilis panduan baru yang berbunyi, 'Hei, kami ingin Anda hadir dengan pemahaman yang lebih baik tentang potensi liabilitas farmakodinamik dari perspektif toksisitas, jendela terapeutik. Namun kami juga ingin Anda merancang uji klinis sedemikian rupa sehingga kami dapat memperoleh gambaran tentang dosimetri. Kami dapat memperoleh gambaran bagus mengenai toksisitas dari sudut pandang akut, namun kami ingin Anda memantau pasien ini dalam jangka waktu yang lebih lama untuk mencari toksisitas kronis yang mungkin timbul. Dan kami ingin Anda mencoba dosis terapi yang berbeda, jadwal terapi yang berbeda. Kami benar-benar ingin Anda melakukan banyak hal dalam hal ini, sehingga jika kami mempertimbangkan untuk menyetujuinya, kami memiliki pemahaman yang lebih baik, atau pemahaman terbaik, tentang apa yang diterima oleh pasien ini'.
Teknologi Farmasi: Apa saja tantangan yang ada dalam uji klinis radiofarmasi untuk mengobati kanker?
Ritchie (Juara Onkologi): Saya pikir ada tantangan ilmiah dan logistik di sini. Dari sisi ilmiah, kita sebenarnya tidak mengetahui apa yang tidak kita ketahui. Ini belum ada sejak lama, jadi kita benar-benar tidak mengetahui jenis tumor yang merespons jenis terapi ini. Kami tidak mengetahui jenis toksisitasnya.
Jika Anda berpikir tentang ADC, yang merupakan sepupu kedua dari terapi ini, setelah lebih dari dua dekade melakukan penelitian, kami memiliki pemahaman yang sangat baik tentang jenis organ. Anda dapat dengan mudah mempertahankan jenis terapi tersebut, dan kami tahu cara mengelola perawatan pasien untuk kelas yang berbeda. Untuk (radiofarmaka), kami hanya tidak tahu. Dan hal itu menciptakan tantangan. Saya rasa, kami juga masih belum memahami apa yang membuat radioterapi menjadi yang terbaik dari sudut pandang ilmu farmasi.
Dari sisi pengembangan obat, logistiknya sangat-sangat berbeda. Ini adalah ruang yang sangat diatur. Kita sedang berurusan dengan kedokteran nuklir. Nukleotida itu sendiri tidak tersedia, sehingga menimbulkan tantangan. Dan tentunya tidak semua lokasi klinis yang akan menerima pasien untuk uji klinis disiapkan atau dilengkapi untuk menawarkan jenis terapi ini, sehingga pendaftaran pasien bisa menjadi suatu tantangan.
Dan yang terakhir, nukleotida ini mempunyai waktu paruh dan umur simpan yang pendek. Jadi, obat-obatan tidak bisa diproduksi dan disimpan di lemari es selama berbulan-bulan sambil menunggu digunakan untuk uji coba. Mereka harus dibuat dan kemudian digunakan dalam waktu seminggu, jadi ada beberapa kendala logistik juga.
Referensi
- Staf NCI. Radiofarmasi: Terapi Radiasi Memasuki Era Molekuler. Institut Kanker Nasional. Kanker.gov. 26 Oktober 2020. https://www.cancer.gov/news-events/cancer-currents-blog/2020/radiopharmaceuticals-cancer-radiation-therapy
- FDA. Draf Pedoman Industri, Radiofarmasi Terapi Onkologi: Optimasi Dosis Selama Perkembangan Klinik (OCE, CDER, Agustus 2025). https://www.fda.gov/regulatory-information/search-fda-guidance-documents/oncology-therapeutic-radiopharmaceuticals-dosage-optimization-during-clinical-development
Tentang penulis
Susan Haigney adalah editor utama Teknologi Farmasi®.
Detail artikel
BioPharm Internasional®/ Teknologi Farmasi®/ Teknologi Farmasi® Eropa
Tren Formulasi buku elektronik
Oktober 2025
Halaman: 12-18
Kutipan
Jika mengacu pada artikel ini, mohon kutip sebagai Haigney, S. Mengapa Radiofarmasi Ideal untuk Mengobati Kanker. BioPharm Internasional®/ Teknologi Farmasi®/ Teknologi Farmasi® Tren Eropa dalam Formulasi buku elektronik 2025 Oktober.