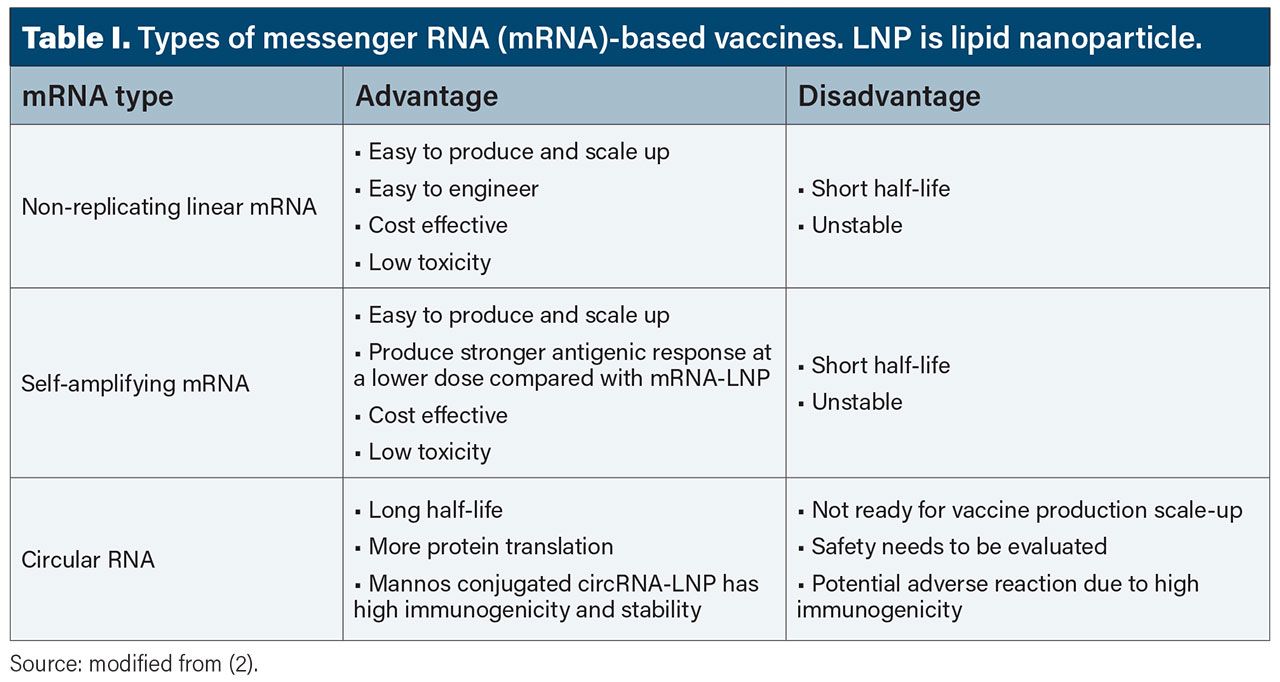
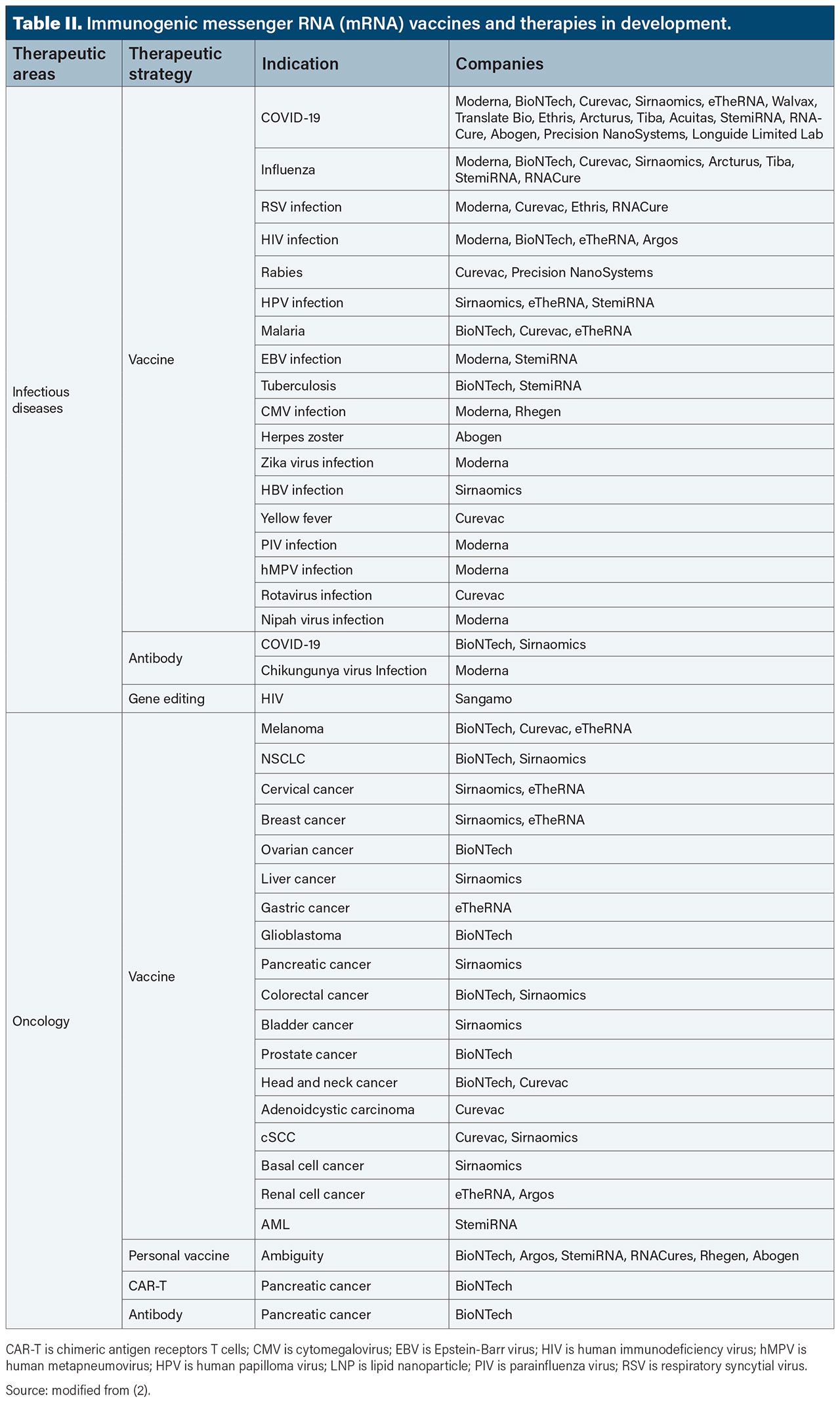
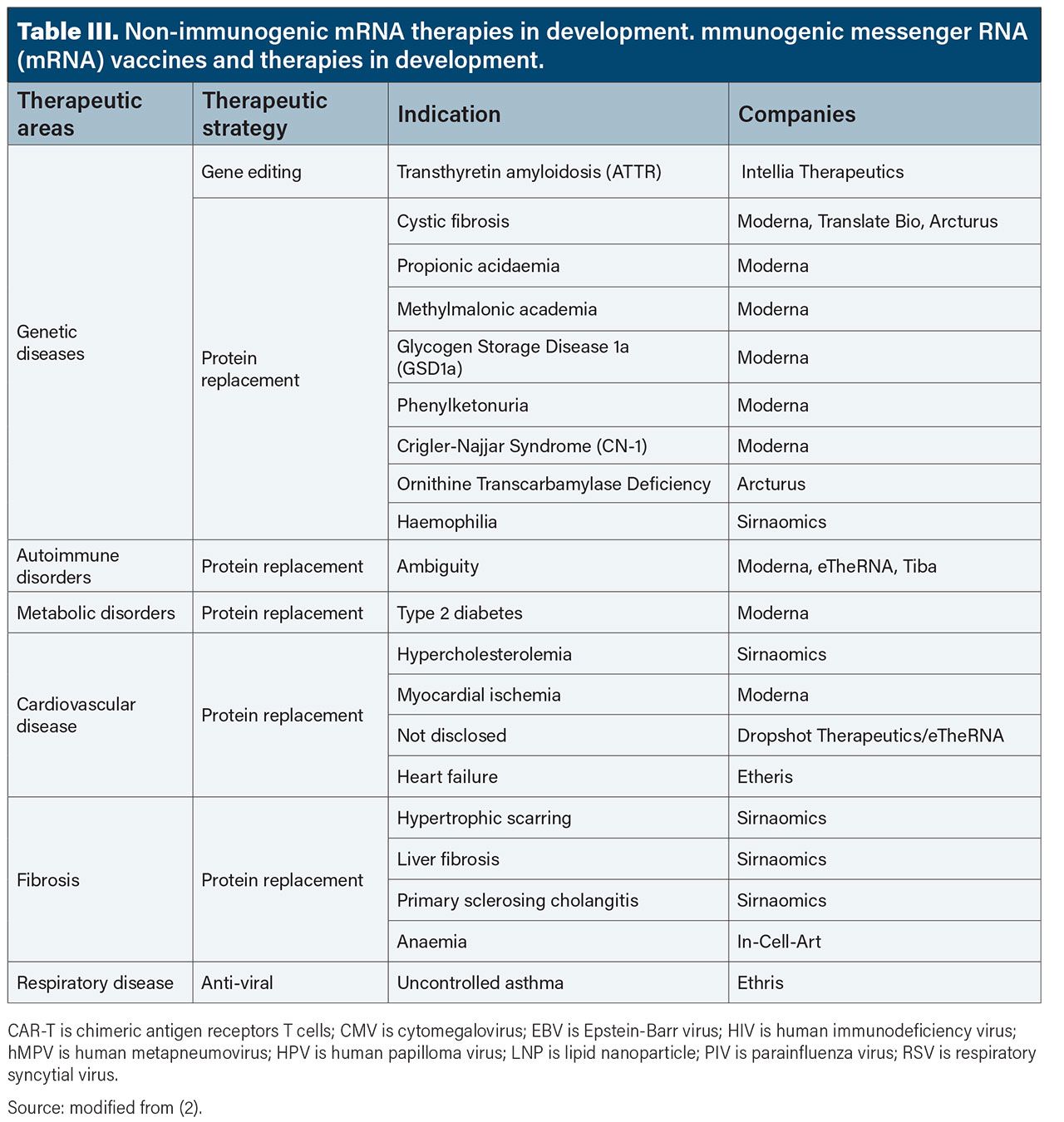
During the past decade, messenger RNA (mRNA)-based therapeutics have shown great promise in immunotherapy (e.g., cancer and vaccines), and non-immunogenic applications (e.g., protein replacement/supplementation therapy, regenerative medicine therapy, and genetic editing) (1). Several types of mRNA-based vaccines have emerged, namely non-replicating linear mRNAs (NRM), self-amplifying mRNAs (saRNAs), and circular mRNAs (circRNAs). Each mRNA type offers advantages and disadvantages (Table I) (2).
mRNA-based vaccines
Technological advances in the design and delivery of mRNA have catalysed the rapid development of mRNA COVID-19 vaccines by Pfizer-BioNTech and Moderna Therapeutics (3–4). Now, mRNA vaccines can be quickly created against different antigenic targets by changing the mRNA sequence, and companies are looking beyond COVID-19 at other infectious diseases, including Epstein-Barr virus, influenza, and Zika (Table II). In May 2024, the US Food and Drug Administration (FDA) approved Moderna’s next-generation base-modified mRNA-lipid nanoparticle (LNP) respiratory syncytial virus (RSV) vaccine mRESVIA (mRNA-1345) in adults aged 60 years and older with lower respiratory tract disease (5).
In addition, manufacturers have begun to evaluate next-generation vaccine modalities in cancer (6). Although therapeutic mRNA-based cancer vaccines have yet to be approved, encouraging results have been reported by CureVac with CVGBM, its LNP-SAM mRNA vaccine CV0905010 in Phase I for glioblastoma (7). Some companies are combining mRNA vaccines with programmed cell death protein 1 (PD-1) inhibitors to activate the immune system and elicit tumour-specific T-cell responses. These include BioNTech/Regeneron with BNT111 plus Libtayo (cemiplimab) for patients with melanoma and Merck & Co./Moderna with LNP-delivered mRNA-4157/V940 in combination with Keytruda (pembrolizumab) also for melanoma (8–9).
mRNA-based therapies
Historically, production costs for mRNA therapies have been high, stability has been poor, and products have been associated with high immunogenicity. However, new strategies in mRNA modification, purification, and sequence design have led to the development of next-generation mRNA-based therapies (Table III). In 2018, following decades of research and development, the first RNA-based therapy, Onpattro (patisiran), from Alnylam Pharmaceuticals reached the market (10). The LNP-encapsulated small interfering RNA (siRNA) was approved by FDA for the treatment of hereditary transthyretin amyloidosis (ATTR), and this opened the door for mRNA-based drugs in many applications. Numerous mRNA technologies are currently under evaluation at various stages of drug development, including Intellia Therapeutics NTLA-2001, an in vivo gene-editing clustered regularly interspaced short palindromic repeats (CRISPR) agent and associated Cas9 endonuclease (CRISPR-Cas9) therapy that uses an mRNA-LNP system to inactivate the TTR gene to treat ATTR amyloidosis (11).
European biotech is leading the field in mRNA technologies
Several European biotech companies are leading the field in mRNA technology, including BioNTech, CureVac, eTheRNA, and Ethris. These companies compete with innovative biotech companies in the United States, such as ADARx Pharmaceuticals, Dicerna Pharmaceuticals, Greenlight Biosciences, Orna Therapeutics, Regulus Therapeutics, and Sirnaomics, as well as Abogen Biosciences and Stemirna Therapeutics in Asia.
BioNTech. German biotech, BioNTech, is developing next-generation personalised therapies, focusing on oncology, cerebral diseases, and COVID-19 vaccines. It co-developed Comirnaty, the COVID-19 vaccine in partnership with Pfizer, and is gearing up for the commercial launch of its variant-adapted COVID-19 vaccine for the 2025/2026 season, pending regulatory approval. It is also developing BNT165e, an RNA-based vaccine for the prevention of P. falciparum malaria. However, FDA has placed the Phase I/II trial on hold, and BioNTech is taking actions to address FDA’s requests and will work with the agency to assess the next steps.
In oncology, the company is leveraging its proprietary cancer vaccine platforms FixVac and iNeST to tailor treatment, and its RiboMab, RiboCytokine, and intratumoural immunotherapy platforms to target tumours directly. It is currently developing multivalent mRNA cancer Immunotherapeutics, which include BNT111 (Phase II, advanced melanoma), BNT113 (Phase II, metastatic head and neck cancer), BNT116 (Phase II metastatic NSCLC), BNT142 (Phase I/II, multiple solid tumours), and combination therapies, such as mRNA-based cancer immunotherapies for the early, adjuvant setting, and an anti-PDL1/ vascular endothelial growth factor A (VEGF-A) bispecific antibody candidate BNT327/PM8002 for the treatment of advanced solid tumours.
The company is developing modified RNA that includes methyl-pseudouridine modifications, nucleoside modifications, saRNAs, and trans-amplifying mRNA, with an improved immunogenetic profile. It is also developing novel delivery formulations to improve the targeted delivery of mRNA; these include lipoplex, LNPs, and polyplexes (12).
BioNTech has collaborations with Bayer, Genentech, Genevant, Fosun Pharma, Pfizer, and Regeneron. In February 2025, BioNTech completed the acquisition of Biotheus to obtain full global rights to BNT327 and all other pipeline candidates for US$800 million, plus additional performance-based payments of up to US$150 million (12). It signed a $1.5 billion strategic partnership in June 2025 with Bristol Myers Squibb to co-develop and co-commercialize next-generation bispecific antibody BNT327 targeted to PDL1 and VEGF-A for multiple solid tumours (13).
CureVac. German biopharmaceutical company CureVac N.V. was founded in 2000 and specialises in the development of mRNA-based vaccines and therapeutics. CureVac leverages its proprietary mRNA technology, with advanced omics and computational tools, to design and develop off-the-shelf and personalised precision immunotherapies to treat cancer (14). The company has been issued more than 1000 patents and is currently involved in patent litigation with BioNTech regarding the application of poly-A tail technology in mRNA constructs (15). In the US, seven patents are being assessed, and the trial is expected to start in September 2025.
CureVac has a broad product portfolio, which includes CVGBM, an off-the-shelf precision immunotherapy in Phase I for glioblastoma, and CVHNLC, a multiepitope mRNA-based precision immunotherapy in Phase I for squamous non-small cell lung cancer. It is also developing prophylactic vaccines for urinary tract infections and influenza/COVID-19, the latter being co-developed by GlaxoSmithKline (14).
The company has established collaborations with myNEO Therapeutics and MD Anderson Cancer Center in the oncology field, CRISPR Therapeutics on the development of gene-based medicines, and Acuitas Therapeutics to develop novel LNP delivery systems and LNP-formulated mRNA candidates. In February 2023, CureVac closed a US$250 million public offering and has a strong cash position to continue the development of its promising pipeline (14, 16).
eTheRNA. Belgium-based eTheRNA was founded in 2013 and developed mRNA and LNP technologies. In 2022, the company raised €39 million in a series B round that included the participation of Chien and Dekkers, co-founders of Dropshot Therapeutics. The company’s lead programme is a triple combination mRNA cancer vaccine that targets cytokines IL-21 and IL-7 and the membrane-bound co-stimulator 4-1BBL, which has shown promising results in triple-negative breast cancer (17). The LNPs provide targeted delivery of the mRNA directly to tumours, resulting in strong immune activation, tumour elimination, and durable immunological responses.
In January 2025, eTheRNA established a collaboration with Dropshot Therapeutics to develop RNA-based therapeutics for multiple new drug candidates across several indications in cardiac and renal diseases. The company will receive up to US$950 million, which includes an upfront payment plus milestone payments and tiered royalties following product launch (18). eTheRNA is working with Hasselt University on autoimmune mRNA therapeutics and Almirall on a multi-target alliance in medical dermatology (19–20).
Ethris. Ethris GmbH was founded in Germany in 2009 and is a clinical-stage biotechnology company developing next-generation RNA therapeutics and vaccines based on non-immunogenic messenger RNA (SNIM RNA) and lipidoid nanoparticle (SNaPL). Its lead candidate, ETH47, is a broad-spectrum antiviral with a virus and mutation-independent mechanism, encoding interferon lambda. The product uses the SNaPL technology for inhalation or intranasal delivery and can be combined with existing antivirals to improve clinical outcomes in respiratory diseases such as uncontrolled asthma. In May 2025, the company was awarded a €10 million EU4Health Grant to support clinical development and expand antiviral applications of ETH47 and US$5 million from Coalition for Epidemic Preparedness Innovations (CEPI) and US$5 million from the Gates Foundation to develop its next-generation RNA therapeutics and vaccines (21–23). Etheris has collaborations with Lonza to develop spray-dried mRNA vaccines for respiratory diseases and HEQET Therapeutics to develop RNA-based therapeutics for heart attack and heart failure (24-25).
The future of mRNA vaccines and therapies
The global mRNA therapeutics and vaccines market is estimated at US$64.5 billion in 2024 and is forcasted to reach US$71.7 billion by 2034, exhibiting a compound average growth rate of 1.2% during 2025–2034 (26). The market will be driven by the rising incidence of chronic diseases and increasing awareness of the widespread potential of mRNA technology, the emergence of next-generation immunotherapy and non-immunotherapy drugs, and vaccines. Leading pharma and biotech companies, such as AstraZeneca, Daiichi Sankyo, GlaxoSmithKline, Moderna, Pfizer, Sangamo Therapeutics, and Sanofi, have made significant investments in this field, and numerous mRNA therapies and vaccines have entered clinical development (27).
To date, mRNA-based products have demonstrated great potential in combating a broad range of diseases either as monotherapies or in combination with approved agents. mRNA technology is constantly evolving, and the next-generation circRNA and saRNAs are likely to supersede mRNA linear formats in vaccine development due to increased immunogenicity and durability. However, the successful implementation of these next-generation products will rely on the development of targeted delivery vehicles and may also require additional modification to the mRNA molecule to improve safety and efficacy.
References
- Shi, Y.; Shi, M.; Wang, Y. et al. Progress and Prospects of mRNA-based Drugs in Pre-clinical and Clinical Applications. Signal Transduction Targeted Therapy 2024 9, 322.
- Lu, R.M.; Hsu, H.E.; Perez, S.J.L.P. et al. Current Landscape of mRNA Technologies and Delivery Systems for New Modality Therapeutics. Journal of Biomedical Science 3, 2024 1, 89.
- Mullard, A. Pfizer’s COVID-19 Vaccine Secures First Full FDA Approval. Nature Reviews Drug Discovery 2021 20, 728.
- Moderna. Moderna Receives Full U.S. FDA Approval for COVID-19 Vaccine Spikevax. News Release. 31 Jan. 2022
- Mullard, A. FDA Approves mRNA-based RSV Vaccine. Nature Reviews Drug Discovery 2024 23, 487, 2024.
- Dolgin, E. Personalized Cancer Vaccines Pass First Major Clinical Test. Nature Reviews Drug Discovery 2023 22, 607-609.
- CureVac. CureVac’s CVGBM Cancer Vaccine Induces Promising Immune Responses in Phase 1 Study in Glioblastoma Presented at the ESMO 2024 Congress. News Release. 13 Sept. 2024.
- Cancer Network. BNT111/Cemiplimab Combo Significantly Improves ORR in Unresectable Melanoma. 30 July 2024.
- Moderna. Moderna & Merck Announce 3-Year Data For mRNA-4157 (V940) in Combination With KEYTRUDA(R) (pembrolizumab) Demonstrated Sustained Improvement in Recurrence-Free Survival & Distant Metastasis-Free Survival Versus KEYTRUDA in Patients With High-Risk Stage III/IV Melanoma Following Complete Resection. News Release. 3 June 2024.
- Alnylam. Alnylam Pharmaceuticals Press Release | Aug 10, 2018 | Alnylam Announces First-Ever FDA Approval of an RNAi Therapeutic, ONPATTRO™ (patisiran) for the Treatment of Hereditary Transthyretin-Mediated Amyloidosis in Adults. News Release. 10 Aug. 2018.
- Intellia Therapeutics. Intellia Therapeutics Announces First Patient Dosed in the Phase 3 MAGNITUDE Study of NTLA-2001 as a Single-Dose CRISPR-Based Treatment for Transthyretin Amyloidosis with Cardiomyopathy. News Release. 18 Mar. 2024.
- BioNTech. BioNTech Announces First Quarter 2025 Financial Results and Corporate Update | BioNTech. News Release. 5 May 2025.
- BioNTech. BioNTech and Bristol Myers Squibb Announce Global Strategic Partnership to Co-Develop and Co-Commercialize Next-generation Bispecific Antibody Candidate BNT327 Broadly for Multiple Solid Tumor Types. News Release. 2 June 2025.
- CureVac. CureVac Announces Financial Results for the Fourth Quarter and Full-Year 2024 and Provides Business Update.News Release. 10 Apr. 2025
- CureVac. CureVac Receives Additional Positive Validity Decision from European Patent Office in Ongoing Litigation Against BioNTech SE. News Release. 15 May 2025.
- CureVac. CureVac Announces Closing of $250 million Follow-on Public Offering of Common Shares. News Release. 10 Feb. 2023
- Etherna. The Discovery of mRNA Therapy that Eradicates Tumours in Preclinical Trials. News Release. 10 Dec. 2024.
- Etherna. Strategic Multi-target Collaboration with Dropshot Therapeutics. News Release. 9 Jan 2025.
- Etherna. Etherna and Hasselt University Announce Autoimmune mRNA Therapeutics Research Collaboration. News Release. 21 May 2024.
- Etherna. Almirall and Etherna Enter into a Multi-target Alliance to Develop mRNA-based Therapies in Medical Dermatology., News Release 12 Dec. 2023.
- Ethris. €10M EU4Health Grant for ETH47. News Release. 6 May 2025.
- Ethris. $5M CEPI Grant for Spray-dried Mucosal Vaccines. News Release 11 Feb. 2025.
- Ethris. $5M ETH47 Funding. News Release. 18 June 2024.
- Ethris. €10M EU4Health Grant for ETH47. News Release. 6 May 2025.
- Ethris. Heqet Collaboration. News Release. 13 Nov. 2023.
- Expert Market Research mRNA Vaccines and Therapeutics Market Report and Forecast 2025-2034. 2 Jan. 2025.
- EMR. Top 8 mRNA Vaccines and Therapeutics Companies. 2025.
About the author
Cheryl Barton, PhD, is founder and director of PharmaVision, Pharmavision.co.uk.